La bioquímica del agua en el helado

La relación de colaboración entre la profesora de Bioquímica y Biología Molecular de la Universidad de Alicante, Rosa María Martínez-Espinosa, y el heladero de Villena, José Luis García Rico, comienza cuando la primera se vuelve una clienta habitual del segundo. El propietario de La Ibense había estudiado en el Curso de Experto Universitario en Elaboración Artesanal de Helados y formaba parte de una de las primeras promociones. Apasionada de la nutrición, y convencida de que introduciendo pequeños cambios en la receta se puede conseguir mejorar la textura, el sabor y el color del helado, Rosa María empieza a colaborar con el heladero en diferentes proyectos. Uno de ellos es la creación de nuevas líneas de helado que pronto verán la luz.
En este artículo el heladero de segunda generación familiar y la profesora de Bioquímica unen experiencia y conocimientos para hablar sobre la importancia del agua en el producto final. Y es que a menudo se subestima su incidencia, sin tener en cuenta que el tipo y la calidad del agua influyen en aspectos del helado tan importantes como la textura y el sabor.
Introducción
Pocas veces se analizan en conjunto, de forma sencilla, clara y divulgativa, aspectos químicos relativos a la elaboración de los helados en las revistas profesionales. Y sin embargo, éste es un planteamiento que debería tenerse en cuenta, puesto que el obrador de cualquier heladero y pastelero, pero también la cocina del cocinero, por poner otros ejemplos, es en realidad un laboratorio con formulaciones químicas (recetas), equipamientos específicos (maquinaria para la elaboración de los helados) y reacciones químicas entre moléculas (aquéllas que constituyen los aceites, mantequilla, frutas, leche, etc.) para dar lugar a un producto exquisito y altamente nutritivo como el helado.
En este escenario y desde el punto de vista bioquímico, el agua aparece como la molécula quizás más olvidada en los foros, publicaciones y recetarios relativos a los helados. El agua, disolvente universal y molécula indispensable para la vida, fue la primera materia prima para la producción de los helados en combinación con las frutas. Aún estando presente ya en los orígenes del helado, resulta sorprendente la falta de información y datos sobre cómo varía la solubilidad de determinados compuestos de los helados, cómo incide en la textura y el sabor en función del tipo y calidad del agua que se utiliza para la elaboración.
Este artículo de divulgación se presenta pues con el objetivo de poner de manifiesto la importancia de la naturaleza del agua en la elaboración de los helados y recoger en líneas generales ideas básicas sobre cómo el agua puede influir en la calidad final del helado.
| Parámetro | Valor |
|---|---|
| pH | 6,5-8,5 |
| Conductividad eléctrica | 300-500 S/cm a 20ºC |
| Dureza | 70-120 mg/L CaCO3 |
| Bicarbonatos | 290 mg/L |
| Sulfatos | 44 mg/L |
| Cloruros | 36 mg/L |
| Calcio | 75 mg/L |
| Magnesio | 20 mg/L |
| Sodio | 15 mg/L |
| Sílice | 7 mg/L |
Características físico-químicas del agua
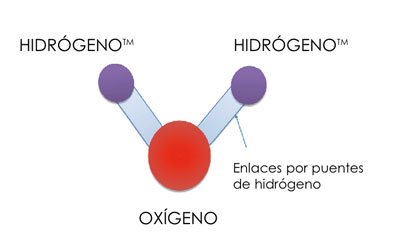
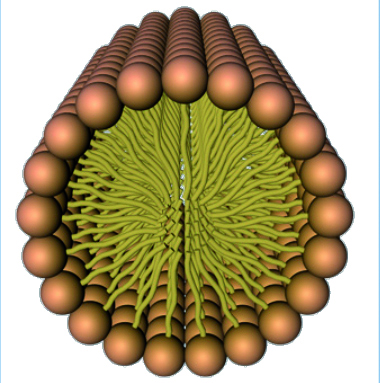
El agua, definida de forma muy básica como líquido incoloro, inodoro y sin sabor, es en realidad una molécula constituida por dos átomos de hidrógeno y uno de oxígeno (Figura 1). Gracias a sus propiedades físico-químicas (Tabla 1), en el seno del agua se pueden disolver moléculas de muy diferente naturaleza química: sales, iones, moléculas polares como muchos hidratos de carbono, compuestos apolares (repelen el agua pero gracias a la formación de micelas pueden solubilizarse en agua (Figura 2) y anfipátipos (compuestos químicos con una región hidrofílica, es decir, con afinidad con el agua; y una región hidrofóbica, esto es, que repelen el agua. Un ejemplo de este tipo de moléculas lo constituyen algunas grasas).
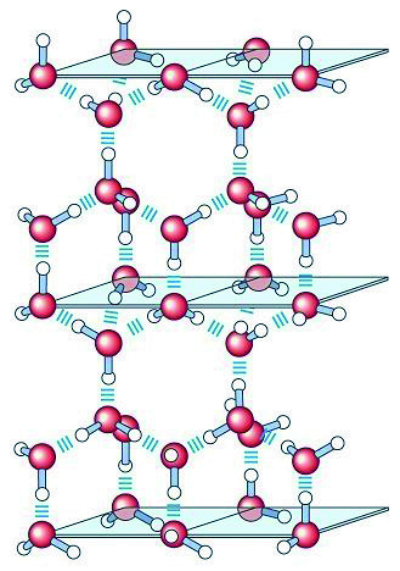
El agua se presenta en estado sólido (hielo) cuando la temperatura a la que está sometida es inferior a 4º C, es líquida a temperaturas superiores a 4º pasando a estado gas cuando la temperatura alcanza valores superiores a 100 ºC. En la forma de hielo, cada molécula de agua forma un máximo de cuatro enlaces (enlaces tipo puentes de hidrógeno) con otras moléculas de agua creando una red cristalina regular que juega un papel importante en el proceso de congelación de los alimentos en general y de los helados en particular (Figura 3).
El agua en el helado
El agua que consumimos a diario (ya sea embotellada o de la red), la que utilizamos para lavar y cocinar nuestros alimentos, no es sólo agua entendida como conjunto de moléculas constituidas por un átomo de oxígeno y dos de hidrógeno. Ese agua contiene iones y sales minerales en mayor o menor concentración, en función de su procedencia y de los posibles tratamientos a los que haya sido sometido (red de alcantarillado, etc.).
Aunque lo esperable sería encontrar agua transparente e incolora, rara vez es insabora y totalmente carente de turbidez
Por tanto, aunque lo esperable sería encontrar agua transparente e incolora, rara vez es insabora y totalmente carente de turbidez. Paladares educados, entrenados o simplemente de gran sensibilidad al gusto, encuentran diferencias entre el sabor del agua recién extraída de un manantial de alta montaña o agua de la red antes y después de un proceso de ósmosis o cloración. Esas diferencias son simplemente debidas a la cantidad y variedad de sales e iones presentes en el agua, que a su vez van a modificar otros parámetros como, por ejemplo, la conductividad eléctrica (capacidad que tiene el agua para conducir la corriente eléctrica, que es tanto mayor cuanto más grande es la concentración de sales disueltas en agua), el pH, o la capacidad de solvatación del agua (capacidad del agua para disolver compuestos). El resultado de la presencia de sales e iones en el agua hace que:
- El agua presente sabor, a veces incluso desagradable al paladar.
- Se modifica la capacidad de solvatación, o dicho de otra manera, la capacidad del agua para disolver compuestos queda alterada.
- Las sales presentes en el agua, sobre todo si su concentración no es despreciable, puede alterar el punto de congelación del agua y por tanto la textura final.
En resumen, la calidad del agua y sus propiedades físico-químicas deberían ser tenidas en cuenta en cualquier receta, pues de su calidad y composición van a depender también el sabor y la textura final del helado.
Cabe plantearse ahora la siguiente pregunta: ¿Qué características debe tener un agua de calidad para la elaboración de helados? Aplicando la lógica y razonando todo lo anteriormente expuesto, un agua con bajo contenido en sales e iones (y por tanto baja conductividad eléctrica) y un pH próximo a la neutralidad, en principio, sería una buena materia prima para el helado (véase Tabla). Aguas como por ejemplo las de la red del sureste de la península ibérica, ricas en distinto tipo de sales entre ellas carbonatos, son aguas duras con sabor y con un grado variable de solubilidad de los compuestos. Debido a este efecto, son ya muchos los heladeros de esa zona que someten el agua de la red a procesos de tratamiento para retirar parte de las sales que interfieren en el sabor final y/o en la solubilidad de los distintos compuestos empleados para la elaboración del helado. De ahí que aunque se utilice la misma receta el resultado no será el mismo si el helado se hace en Galicia o en Alicante, porque el agua empleada será diferente. Si en Alicante el profesional se encontrará con un agua dura, rica en sales minerales, en Galicia será más blanda.